옛날에 휴대용 에너지를 만드는 유일한 방법은 증기나 연료였습니다. 배터리가 발명된 후 수명이 그 어느 때보다 쉬워졌습니다. 요즘 모든 사람들은 일상적인 작업을 쉽게 할 수 있는 휴대용 기계를 찾고 있습니다. 이 경우 배터리는 이동 중에도 에너지를 생산해야 하는 요구 사항을 충족할 수 있습니다.
의심할 여지 없이 배터리는 매우 작고 둔해 보이지만 확실히 작은 실린더를 자신의 마이크로 발전소로 바꿀 수 있습니다. 휴대용 전력을 생성한다는 아이디어는 새로운 것이 아니며 선사 시대 인간도 목재와 연료를 사용하여 전력을 생산하는 데 사용되었습니다. 배터리가 즉각적인 전원 공급 장치라는 것입니다. 버튼을 누르기만 하면 암실이 순식간에 밝아지거나 그보다 더 짧게 밝아질 수 있습니다.
시장에는 여러 종류의 배터리가 있습니다. 이러한 모든 배터리는 화학 에너지를 전기 에너지로 변환하는 동일한 원리로 작동합니다.
배터리의 역사
1800 년 Volta는 특정 유체가 도체로 사용될 때 지속적인 전력을 생성 할 수 있음을 발견했습니다. 이 발견은 배터리라는 최초의 볼타 전지로 이어집니다. Volta의 배터리 발명은 배터리 실험의 새로운 시대를 열었습니다. 그리고, 많은 과학자들이 배터리를 만들기 위해 다양한 실험을 시도했습니다. 그러나 그들 중 소수만이 결론에 도달 할 수있었습니다. Volta와 Daniel은 각각 Voltaic과 Daniel로 알려진 두 명의 과학자가 만든 셀였습니다.
볼타익 셀: 볼타 전지는 화학 반응을 사용하여 전기 에너지를 생산합니다. 하나의 양극과 음극은 서로 반대 방향으로 만들어집니다. 양극에서는 산화가 일어나고 음극에서는 환원이 일어난다. 회로를 완성하기 위해 그 사이에 소금 다리가 만들어집니다. 산화와 환원이 일어나는 부분을 반쪽 전지라고 합니다. 외부 회로는 전자의 흐름을 전도하는 데 사용됩니다.
Volta가 발명 한 볼타 전지는 휴대성이 좋지 않았고 단점도 너무 많았습니다. 그 후 "John Fredric Daniel"이 디자인 한 Daniel의 셀이 인기를 얻습니다.
다니엘 셀: voltaic 전지의 발명 후에, 다니엘 셀은 전기의 근원으로 이른 세기에서 대중적이었다. 이 셀 유형에서는 컨테이너가 두 개의 구획으로 나뉩니다. 갭은 이온을 투과할 수 있는 멤브레인에 의해 만들어졌습니다. 성분 중 하나에서, 아연 전해질은 황산 아연 용액에 담갔다. 다른 구획에서, 구리 전극을 황산구리 용액에 침지시켰다. 셀은 아연이나 황산구리가 고갈될 때까지 전류를 전달할 수 있었습니다.
1859년 Gaston Plante가 설계한 납축전지는 배터리의 충전식 기능으로 인해 인기를 얻었습니다. 배터리의 심플한 디자인은 배터리로 다시 흐르는 전류를 반대로 하여 재충전을 가능하게 했습니다. 이 배터리는 자동차 배터리, 자동차 등과 같은 많은 곳에서 여전히 사용됩니다.
또한 Leclanche 배터리는 Carl Gessner가 액체 전해질이 없는 건식 설계로 발명했습니다.
르클랑슈 셀을 살펴보자.

이 발명은 엎지르고 배향 문제가 완전히 근절되었기 때문에 건전지의 사용을 아주 쉽고 그리고 편리하게 만들었습니다. 다시 말하지만, 일반적으로 알카라인 배터리로 알려진 니켈-카드뮴 배터리가 발명되었습니다. 1970 세기에는 대부분의 리튬 배터리가 휴대용 장치에 사용되도록 발명되었습니다.
배터리의 일반 화학 :
배터리에는 음극, 양극 및 분리기의 세 가지 레이어가 있습니다. 배터리의 음극층을 양극이라고 하고 양극층을 음극이라고 합니다. 배터리에 부하가 연결되면 전류가 양극을 통해 음극으로 흐르기 시작합니다. 마찬가지로 배터리 충전기를 연결하면 전류가 반대 방향, 즉 음극에서 양극으로 흐르기 시작합니다.
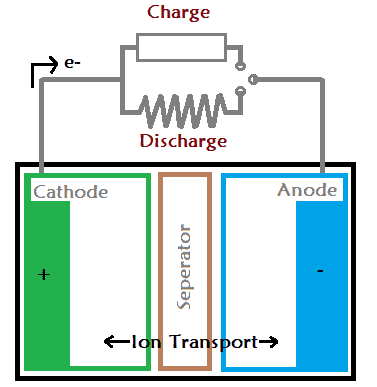
모든 배터리는 산화-환원 반응이라는 화학 반응을 일으킵니다. 반응은 분리막(전해질)을 통해 음극과 양극 사이에서 일어난다.
결과적으로 하나의 전극은 산화 반응으로 인해 음전하를 띠게 됩니다. 그리고 음전하를 띤 전극을 음극이라고 합니다. 두 번째 전극은 환원 반응으로 인해 양전하를 띠게 되며, 이를 양극이라고도 합니다. 두 종류의 금속이 동일한 전해질 용액에 담기면 전극 중 하나는 전자를 얻고 다른 하나는 전자를 잃습니다.
결과적으로 금속 중 하나는 전자를 잃고 다른 금속은 전자를 얻습니다. 두 금속의 전자 농도의 차이는 금속 사이에 전위차를 일으킨다. 이 전위차는 모든 전기 장치의 전압 소스로 사용할 수 있습니다.
이온은 분리기를 통해서만 흐르고 양극에서 음극으로의 모든 이동을 차단합니다. 따라서 전류를 빼내는 유일한 방법은 배터리 단자를 사용하는 것입니다.
다양한 유형의 배터리
배터리는 일반적으로 가정용 기기 및 산업 응용 분야에 사용됩니다. 각 배터리는 지정된 목적을 달성하도록 설계되었으며 요구 사항에 따라 사용할 수 있습니다. 배터리에는 주로 1차 전지와 2차 전지라는 두 가지 범주가 있습니다. 그러나 배터리는 크게 1차 전지, 2차 전지, 연료 전지 및 예비 전지의 4가지 범주로 분류됩니다. 다음은 다양한 유형의 배터리와 작동에 대해 알아야 할 모든 것입니다.
- 기본 셀
- 2차 전지
- 셀 예약
- 연료전지
기본 셀(비충전식 배터리)
비충전식 배터리는 1차 전지 또는 1차 전지라고도 합니다. 1차 배터리는 저장된 에너지가 완전히 사용되면 다시 사용할 수 없는 배터리입니다. 이 배터리는 외부 소스로 에너지를 복원할 수 없습니다. 이것이 1차 전지를 일회용 배터리라고도 하는 이유입니다.

1차 배터리의 수명을 단축시키는 주요 요인은 사용 중에 극성이 발생한다는 것입니다. 분극 효과를 줄여 배터리 수명을 연장하기 위해 화학적 탈분극, 즉 셀에 산화제를 첨가하여 수소를 물로 산화시키는 방법이 사용됩니다. 마찬가지로, 아연-탄소 전지 및 Leclanche 전지에서는 이산화망간이 사용되고, 분젠 전지 및 그로브 전지에서는 질산이 사용됩니다.
1 차 셀의 응용 :
- 시계와 장난감에 사용할 수 있습니다
- 소형 가정용 기기에 사용할 수 있습니다
- 개인용 컴퓨터에서 사용할 수 있습니다
- 휴대용 비상등 및 인버터에 사용할 수 있습니다
비충전식 배터리는 다양한 유형이 있습니다.
- 아연-탄소 배터리(일명. '헤비 듀티')
- 알칼리성
- 리튬 전지
- 산화은 전지
- 아연 공기 전지
아연-탄소 배터리
아연-탄소 배터리는 매우 낮은 전력을 제공하는 최초의 상업용 건전지이며 건전지라고도 합니다. 탄소 막대가 배터리에 배치되어 이산화망간 전극에서 전류를 수집합니다. 1.5Volts의 DC 공급을 제공할 수 있습니다. 이러한 유형의 배터리는 손전등, 라디오, 리모콘 및 벽시계에 사용됩니다.
알칼리성
알카라인은 또한 건전지이며 아연 양극과 이산화망간 음극으로 구성됩니다. 알카라인 배터리는 강철 캔으로 포장되어 있으며 가장 바깥쪽 내부 영역은 이산화망간으로 채워져 있습니다. 아연과 수산화칼륨 전해질은 전지의 가장 중앙 영역에 채워져 있다. 알카라인 배터리는 다른 배터리보다 밀도가 높습니다. 일반적으로 오디오 플레이어, 라디오 및 횃불 조명에 사용됩니다.

리튬 전지
리튬 전지 배터리는 동전 또는 버튼 유형 디자인 형태로 제공됩니다. 아연, 알카라인 및 망간 배터리보다 더 높은 전압(3V) 값을 제공합니다. 리튬 전지는 크기가 더 작고 무게가 더 가볍습니다. 리튬 전지의 내부 저항은 높으며 충전할 수 없습니다. 많은 전자 응용 분야에서 사용되는 가장 널리 사용되는 코인 셀은 2032V 출력을 제공하는 CR3입니다. 리튬 전지의 수명은 더 깁니다(약 10년).
산화은 전지:
산화은 배터리는 고용량 저전력 배터리입니다. 그들은 수은 전지와 모양이 유사하며 1.5볼트의 더 높은 EMF를 제공합니다. 배터리의 음극은 산화은으로 구성되어 있습니다. 배터리 내부에 존재하는 전해질은 칼륨 또는 수산화나트륨으로 만들어집니다. 은이 비싸기 때문에 이 배터리는 응용 프로그램이 매우 제한적입니다.
산화은 전지의 우수한 특징은 다음과 같습니다.
- 배터리 구조의 독특한 밀봉으로 인해 배터리가 누출되지 않습니다.
- 배터리에 의해 제공되는 정전압 출력은 안정적인 방전을 얻는 데 유용합니다.
- 산화 방지제의 사용은 배터리의 높은 에너지 밀도에 기여합니다.
산화은 전지의 응용:
- IOT 기반 장치
- 전기 시계
- 정밀 기기
- 의료 기기
아연 공기 전지
아연 공기 배터리는 밀봉 해제 직후 5분 이내에 최대 작동 전압에 도달합니다. 이들은 충전식 디자인의 기본 배터리입니다. 공기 중의 산소 함량은 배터리의 활성 질량으로 작용합니다. 음극은 공기가 접근할 수 있는 탄소로 구성된 다공성 몸체입니다. 셀의 출력 전압 용량은 1.65V입니다. 방전하는 동안 아연 입자 덩어리는 전해질로 포화된 다공성 양극을 형성합니다. 공기 중에 존재하는 산소는 하이드록실 이온과 반응하여 징케이트를 형성합니다. 이 징케이트는 산화아연을 형성하고 물은 전해질로 돌아갑니다.
2차 전지(충전식 배터리)
충전식 배터리는 2차 전지라고도 합니다. 배터리를 교체해야 하기 전에 충전에 연결하여 여러 번 사용할 수 있습니다. 충전식 배터리의 초기 비용은 일반적으로 일회용 배터리보다 높지만 이러한 배터리의 총 소유 비용과 환경 영향은 교체해야 하기 전에 여러 번 저렴하게 충전할 수 있기 때문에 더 낮습니다.

2차 전지의 응용:
- 피트니스 밴드, 스마트 시계에 사용할 수 있습니다.
- 군대 및 잠수함에서 사용할 수 있습니다
- 카메라 및 인공 심박 조율기
충전식 또는 2차 배터리는 주로 세 가지 유형이 있습니다.
- 납축
- 리튬 이온(Li-ion)
- 니켈 메탈 하이드라이드(Ni-MH)
- 니켈 카드뮴 (Ni-Cd)
납축
납산은 매우 일반적인 유형의 충전식 배터리입니다. 그들은 일반적으로 품질이 다른 것과 다르기 때문에 태양 에너지로부터 에너지를 저장하는 데 사용됩니다. 이 배터리는 고전류를 제공하며 차량에 사용됩니다. 배터리가 작동을 멈추면 재활용에 사용할 수 있습니다. 모든 배터리 납의 약 93%는 새로운 납산 배터리를 만들기 위해 재활용에 재사용됩니다.

리튬 이온(Li-ion)
리튬 이온 배터리는 리튬 이온 배터리라고도 하는 충전식 배터리입니다. 이 배터리는 전력 밀도가 높기 때문에 전자 제품에 일반적으로 사용됩니다. 이 배터리는 kg당 150와트시를 저장할 수 있습니다. 방전하는 동안 리튬 이온은 음극에서 양극으로 또는 그 반대로 이동합니다. 과열로 인해 배터리가 손상되거나 화재가 발생할 수 있습니다.

니켈 메탈 하이드라이드(Ni-MH)
니켈 메탈 하이드라이드 배터리는 충전식 배터리입니다. 배터리의 금속은 금속 간입니다. 이러한 유형의 배터리는 수명이 길고 전류 용량이 높습니다. kg당 100와트시를 저장할 수 있습니다. 리튬 이온 배터리보다 열적으로 더 안정적입니다. 자체 방전은 다른 배터리보다 높습니다.

니켈 카드뮴 (Ni-Cd)
니커-카드뮴 충전식 배터리에서는 산화니켈 수산화물과 금속 카드뮴이 전극으로 사용됩니다. NiCd 배터리 또는 NiCad 배터리라고도 합니다. Ni-Cd 배터리는 사용하지 않을 때 전압을 유지하고 전하를 유지하기에 좋습니다. 배터리의 미래 용량을 낮추는 원인이 될 수 있는 Ni-Cd 배터리의 가장 큰 단점은 부분적으로 충전된 배터리가 충전되면 "Dreaded Memory Effect"(예를 들어 음 또는 카드뮴 판의 변화는 CD(OH)를 Cd 금속으로 변환하는 것을 수반함) 및 전압 강하의 영향을 받을 수 있다는 것입니다.

니켈 카드뮴은 완전 방전율에서 정격 용량을 전달하기에 좋으며 저온 속도 작동에서 우수한 수명 주기를 가지고 있습니다.
1차 셀와 2차 셀의 차이점:
사양:
1차 전지는 내부 저항이 높고 용량이 높으며 설계가 더 작습니다. 2차 전지는 내부 저항이 낮고 가역적인 화학 반응을 일으키며 설계가 복잡합니다.
디자인:
일차 셀은 일반적으로 건조 셀입니다. 즉, 액체가 없고 배터리 내부의 이온이 이동할 수 있는 페이스트로 가득 차 있습니다. 이것이 일차 셀이 유출에 강한 이유입니다. 그러나 2차 전지는 액체 또는 용융염으로 구성됩니다.
1차 셀와 2차 셀, 장점과 단점을 더 잘 비교하기 위해 아래 주어진 표에서 차이점을 요약했습니다.
| 기본 셀 | 2차 전지 |
| 가벼운 무게와 더 작은 디자인으로 인한 휴대용 응용 분야에 적합 | 휴대용 장치에 적합하지 않음 |
| 우수한 전하 유지 | 열등한 전하 유지 |
| 고비용 응용 분야에는 적합하지 않습니다. | 백업 및 고비용 응용 프로그램에 적극 권장됩니다. |
| 특정 응용 프로그램으로 제한됨 | 매우 다재다능하여 다양한 응용 분야를 가지고 있습니다. |
| 낮은 초기 비용 | 더 높은 초기 비용 |
셀 예약
예비 배터리 또는 셀은 대기 배터리라고도 합니다. 전해질은 융점에 도달할 때까지 고체 상태에서 비활성 상태로 유지됩니다. 녹는점에 도달하자마자 이온 전도가 시작되고 배터리가 활성화됩니다.
예비 셀는 세 가지 범주로 더 분류됩니다.
- 물 활성화 배터리
- 열 활성화 배터리
- 전해질 활성화 배터리
- 가스 활성화 배터리
예비 배터리의 응용 프로그램:
- 시간 및 압력 감지에 사용되는 장치에 사용됩니다
- 주로 무기 시스템에 사용됩니다
- 또한 자동차 배터리 및 기타 차량에 사용됩니다
연료전지
이 등급의 배터리에서 활성 물질은 외부 소스에서 공급됩니다. 연료 전지는 활물질이 전극에 공급되는 한 전기 에너지를 생산할 수 있습니다. 양성자 교환막은 수소와 산소 가스를 연료로 사용합니다. 반응은 셀 내부에서 일어나며 반응물의 생성물로 전기와 열이 생성됩니다. 연료 전지의 네 가지 기본 요소는 양극, 음극, 전해질 및 촉매입니다.
연료 전지 뒤에 사용되는 기술의 장점:
- 화학적 위치 에너지를 전기 에너지로 직접 변환하는 과정은 "열 병목 현상"을 방지합니다.
- 셀에 움직이는 부품이 없기 때문에 편리하고 신뢰성이 높습니다
- 환경 친화적 인 방식으로 수소를 생산하기 때문에 다른 환경에 비해 환경에 비교적 덜 해롭습니다.
연료 전지의 응용
- 주로 자동차, 버스 및 기타 자동차와 같은 운송 수단에 사용됩니다.
- 정전 시 전기를 생산하기 위한 백업으로 매우 자주 사용됩니다.
다른 전원에 비해 배터리의 장점
- 특정 에너지 용량: 배터리의 에너지 저장 용량은 화석 연료에 비해 매우 적습니다. 그러나 배터리는 열 엔진에 비해 에너지를 더 효과적으로 전달할 수 있습니다.
- 전력 대역폭: 배터리는 높은 전력 대역폭으로 인해 크고 작은 부하를 보다 효과적으로 처리할 수 있습니다.
- 응답성: 배터리는 단기간에 전력을 공급할 수 있습니다. 이것은 연소 엔진의 경우처럼 워밍업이 필요하지 않음을 의미합니다.
- 환경: 배터리는 사용하기 쉽고 합리적으로 시원하게 유지됩니다. 대부분의 배터리는 다른 연료 기반 엔진의 경우처럼 소음이 나지 않습니다.
- 설치: 오늘날 밀봉된 배터리는 거의 모든 위치에서 작동할 수 있습니다. 충격 및 진동 내성이 우수합니다.
배터리의 단점
- 충전 시간: 기본 배터리가 방전되면 다시 충전하여 사용하는 데 몇 시간이 걸립니다. 이것은 몇 분이 걸리는 연료를 사용하는 경우가 아닙니다.
- 운영 비용: 대형 배터리의 가격과 무게로 인해 안정적인 사용과 대형 차량에는 비실용적입니다.
- 에너지 저장 용량: 화석 연료에 비해 배터리의 에너지 저장 용량은 낮습니다.
전기 자동차(EV) 배터리
전기 자동차 배터리는 지속적으로 전력을 공급하도록 설계되었습니다. 다른 배터리와 다른 점은 점화와 번개입니다. 전기 자동차 배터리는 신뢰성과 환경 친화적 인 특성으로 인해 시장에서 점유율을 높이고 있습니다.

현대 자동차에서 가장 일반적인 배터리는 리튬 이온과 리튬 폴리머 배터리입니다. 셀은 모듈 형태로 설치됩니다. 즉, 팩을 만들기 위해 한 가지 형태의 배터리를 설치합니다. 총 96개의 셀이 설치된 BMW 전기차를 예로 들어보자. 외부 열과 진동으로부터 배터리를 보호하는 프레임에 넣는 셀의 수입니다. 셀의 조합을 모듈이라고 합니다.
이러한 여러 모듈, 냉각 팩 및 배터리 관리 시스템이 함께 결합되어 팩을 형성합니다.
전기 자동차에 사용되는 리튬 이온 배터리의 두 가지 주요 유형은 다음과 같습니다.
- 메타 산화물
- 인산염
차량과 같은 자동차 응용 분야에서 리튬 이온 배터리는 화학적 위험과 편의성 측면에서 더 안전합니다.
전기차 배터리 제작
현재 전기 자동차는 리튬 배터리로 운행되고 있습니다. 리튬 전지의 정상 전압은 3.7V이지만 EV(전기 자동차)는 300V가 필요합니다. 이 전압 및 전류 값을 달성하기 위해 리튬 전지는 직렬 및 병렬로 결합됩니다. 이러한 리튬 전지의 조합은 모듈로 알려져 있습니다. 이 모듈에는 보호를 위한 BMS(배터리 관리 시스템)가 함께 제공됩니다. 아래는 필요한 전압을 달성하기 위해 만들어진 리튬 전지 모듈을 보여주는 Nissan Leaf의 사진입니다.

'데이터계측분석 > 전기전자 기술자료' 카테고리의 다른 글
| 단일 종단 및 차동 신호 (1) | 2023.09.12 |
|---|---|
| ELCB (누전 회로 차단기) (0) | 2023.09.10 |
| 디지털 로직 앤드게이트 (0) | 2023.09.09 |
| RS232통신 - MAX232 구성, 동작, 유형 (0) | 2023.09.08 |
| AWG 와이어 게이지 및 전류용량 (0) | 2023.09.08 |